Épidémiologie de la leptospirose canine en France métropolitaine

La leptospirose canine est une maladie bactérienne de répartition mondiale causée par des leptospires du groupe pathogène dont le tropisme est rénal. Elle peut être associée à des signes cliniques évocateurs comme l’ictère flamboyant et insuffisance rénale aigue, orientant le diagnostic du clinicien. Pour gérer des tableaux cliniques, moins évocateurs, le risque de transmission associé à un cas ou mettre en oeuvre des mesures préventives, le clinicien doit s’appuyer sur des informations épidémiologiques actualisées.
La place du chien dans le cycle épidémiologique des infections par Leptospira
Le groupe pathogène du genre Leptospira est un ensemble de bactéries réparties en sérogroupes. Ces bactéries sont multi-hôtes et peuvent infecter tous les mammifères avec toutefois des conséquences cliniques et des durées variables de l’infection rénale et de l’excrétion urinaire selon les espèces et les individus.
Pour l’humain et les autres espèces sensibles comme le chien, les bactéries du groupe pathogène sont toutes potentiellement responsables d’une infection aiguë et fatale. La transmission bactérienne se fait essentiellement selon un mode indirect, par contact avec le sol ou l’eau, contaminé par des urines de mammifères infectés. La transmission directe reste possible lors de proximité étroite avec un animal infecté.
Dans un écosystème, chaque espèce de mammifère a une contribution relative dans la contamination du milieu selon la durée de l’infection et de l’excrétion bactérienne. Par exemple, le rat surmulot, le ragondin et le rat musqué peuvent substantiellement contribuer à la contamination du milieu (Fig 1). Les enquêtes récentes menées par VetAgro Sup suggèrent que le campagnol et le hérisson pourraient également être des sources majeures de contamination du milieu1. D’autres mammifères, à l’instar des lagomorphes et des ongulés sauvages, ont, à l’inverse, une contribution limitée.
Le rôle des chiens en tant que sources potentielles de l'infection pour les autres animaux et les humains n’est pas clair à ce jour. Récemment, en France, parmi une meute de chiens apparemment en bonne santé, l'excrétion urinaire était de 20%2. Cependant, aucun cas récent de transmission entre congénères ou du chien à l’humain n’a été rapporté et ne suggère le rôle limité du chien en tant que source de transmission des leptospires ou de contamination du milieu. Le chien reste néanmoins décrit comme une sentinelle des sérogroupes de leptospire présents localement3.
Mise en application
Les chiens (et les chats) ont un rôle limité en tant que réservoirs de l'infection pour les autres animaux et les humains.
Quelles est la conduite à tenir vis-à-vis des congénères d'un chien infecté par Leptospira ?
L'infection d'autres chiens qui résident dans le même foyer peut se produire, plus probablement à la suite d'une infection coïncidente provenant du même environnement source, car ils ont généralement un risque d'exposition similaire.
Le consensus d’experts européens recommande de ce fait, un traitement antibiotique pendant deux semaines pour les chiens vivant avec des chiens diagnostiqués avec la leptospirose4.
Quelles est la conduite à tenir vis-à-vis des personnes en contact avec un chien infecté par Leptospira ?
Malgré des contacts intensifs et fréquents avec des chiens infectés, la probabilité de leptospirose des personnes en contact est faible. Une étude du risque de transmission zoonotique auprès des propriétaires et du personnel d'un hôpital vétérinaire soignant des chiens infectés n’a pas rapporté de leptospirose humaine et conclut à l’efficacité des mesures générales d’hygiène5.
Cycle épidémiologique complexe de la leptospirose
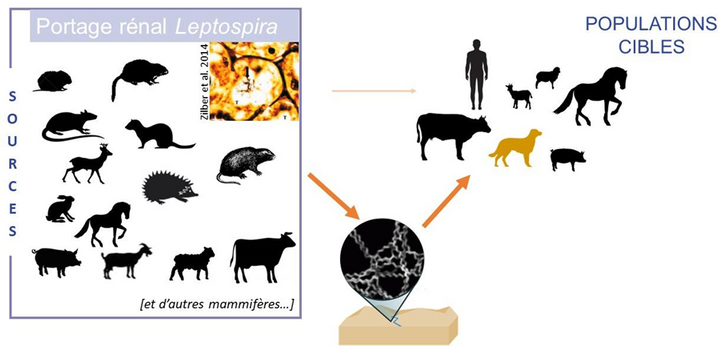
Figure 1 : Cycle épidémiologique des infections par Leptospira à partir des connaissances disponibles en France métropolitaine
Limites du diagnostic clinique et analytique de la leptospirose canine
Les manifestations cliniques associées varient d’infections multi-systémiques et sévères incluant l’insuffisance rénale, les dysfonctions hépatiques, les coagulopathies, les gastro-entérites et détresses respiratoires à des signes frustes voire absents. Dans les formes frustes ou particulières, le vétérinaire fait face à un diagnostic différentiel complexe dans lequel la leptospirose n’est parfois pas envisagée en premier lieu.
La suspicion clinique peut être confirmée par la sérologie, le Test de Micro agglutination (MAT) ou par les tests moléculaires de détection directe (PCR). La bactériémie et la bactériurie sont transitoires pouvant mener à des résultats faussement négatifs par les tests de détection directe selon la date de prélèvement. Le MAT est le test de référence pour le diagnostic, que ce soit en médecine humaine ou vétérinaire et fournit un dosage semi-quantitatif des anticorps dirigés contre les leptospires pathogènes. Les anticorps sont produits 7 à 15 jours après l’infection et persistent plusieurs mois, ce qui améliore la sensibilité du test sérologique par rapport au test direct. Néanmoins, l’interprétation du profil sérologique peut être limitée par la vaccination ou une exposition antérieure et l’éventuel portage asymptomatique de leptospires. Un MAT positif devrait donc être systématiquement réitéré 7 à 15 jours plus tard pour confirmer une infection leptospirosique en cours.
L’absence de signes cliniques pathognomoniques et le défaut de sensibilité des tests impliquent un sous-diagnostic tant pour l’humain que pour les animaux domestiques.
Mise en application
Un MAT positif n’indique pas systématiquement une leptospirose, le vétérinaire doit considérer d’éventuels anticorps vaccinaux ou une infection antérieure ou en cours, indépendamment du tableau clinique observé et réitérer le test pour mettre en évidence l’évolution des titres en anticorps.
Un MAT négatif n’indique pas systématiquement une absence de leptospirose, le vétérinaire doit vérifier que le délai entre le début des signes cliniques et le test est d’au moins 7 jours et doit réitérer le test dans le cas contraire.
Le risque de leptospirose canine
La leptospirose clinique est relativement fréquente parmi les chiens; cependant, le taux d’incidence est rarement rapporté au niveau des territoires car nécessairement erroné par le biais de sélection parmi les données enregistrées dans les laboratoires de diagnostic. Les analyses confirmatoires ne sont, en effet, pas systématiques du fait de l’absence de signes cliniques évocateurs, du coût associé aux analyses complémentaires et du recours aux tests diagnostic rapides réalisés au chevet du patient. Les études d’incidences publiées doivent donc être interprétées avec précaution pour tenir compte, a minima, de ce biais.
En Europe, une étude menée en Suisse, à partir d’un recueil systématique d’informations pendant 10 ans (2003-2012), rapportait un taux d’incidence de 6.2 cas/100 000 chiens-année. En France, une étude réalisée à partir des analyses sérologiques confirmatoires enregistrées au Laboratoire des Leptospires de VetAgro Sup, (renommé Laboratoire des Leptospires et Analyses Vétérinaires, depuis 2020) avant la commercialisation des vaccins tétravalents (2008 à 2012) rapportait 747 cas de leptospirose canine. Le taux d’incidence annuelle sur la période de l’étude était de 1,5/100 000 chiens-an. Les données n’étant pas exhaustives, cette valeur est sous-estimée à l’échelle du territoire. Un point important de l’étude était l’absence de variation significative des taux d’incidence mensuelle selon le mois de l’année (Fig 2) et l’absence de variation du taux d’incidence départemental en fonction des paramètres météorologiques (précipitation, température)6.
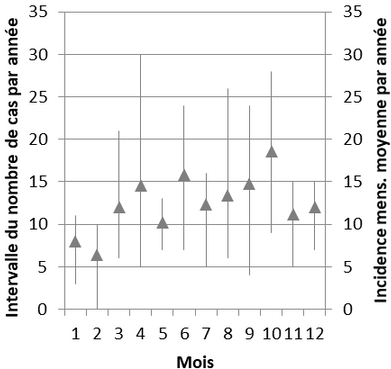
Figure 2 : distribution de l’incidence mensuelle moyenne par année à partir de 747 cas de leptospirose canine entre 2008 et 2011 (triangle, valeur médiane ; droite, distribution des 1er et 3e quartiles)
Par ailleurs, une récente étude cas-témoins réalisée au Royaume-Uni montrait un risque de leptospirose augmenté parmi les chiens de moins d’un an et les chiens vivant en zones rurales7.
Mise en application
En France métropolitaine, les paramètres météorologiques locaux et la période de l’année ne devraient pas être un argument d’exclusion de la leptospirose canine. L’analyse du risque de leptospirose devrait avant tout, se baser sur le mode et le milieu de vie du chien.
Sérogroupes associés aux leptospiroses canines et mesures préventives
L’étude des cas de leptospirose canine enregistrés entre 2008 et 2011 au Laboratoire des leptospires de VetAgro Sup a rapporté une majorité de profils sérologiques en faveur d’une infection par les sérogroupes Australis (63%) et Grippotyphosa (9%). Depuis, la prédominance des profils sérologiques en faveur d’une infection par le sérogroupe Australis perdure parmi les cas cliniques et reste observée en 2021 (n=56/81). Néanmoins, les profils sérologiques en faveur du sérogroupe Grippotyphosa sont anecdotiques en 2021 (n=2/81) au profit d’un plus grand nombre de cas associés au sérogroupe Sejroe (n=14/81). Des cas de leptospirose canine associés à ce sérogroupe ont été récemment décrits en Italie du Nord3,8. Ces rapports de cas soulignent l’importance de rester vigilant malgré l’utilisation de vaccins tétravalents qui visent une protection entre autres, contre les infections par les leptospires du sérogroupe Australis, cependant, n’apportent pas de protection spécifique contre l’infection par le sérogroupe Sejroe. Pour rappel, la vaccination contre un sérovar particulier peut conférer une protection contre les autres sérovars du sérogroupe auquel appartient la souche vaccinale; cependant, il n’y a pas de protection croisée vis-à-vis d’autres sérogroupes.
Une enquête récente interrogeant près de 900 vétérinaires en France indique l’utilisation de vaccins tétravalents pour 83% d’entre eux9. Elle pointe l’importance de sensibiliser les vétérinaires et les propriétaires aux risques d’exposition des chiens au sérogroupe Australis.
Mise en application
D’après les profils sérologiques enregistrés au Laboratoire, les leptospires du sérogroupe Australis sont actuellement prédominantes parmi les leptospiroses canines. Les mesures préventives s’appuient sur un protocole vaccinal suivant les recommandations internationales publiées en 2016 et incluant une protection contre les infections par les leptospires du sérogroupe Australis.
Une attention devrait être portée sur la possible émergence de sérogroupes jusque-là peu rapportés parmi les leptospiroses canines. Elle passe par l’analyse régulière des données sérologiques de laboratoires. Les vétérinaires sont donc encouragés à régulièrement transmettre des spécimens pour analyse confirmatoire auprès de leur laboratoire, en particulier lorsque le chien présente des signes évocateurs de leptospirose malgré un protocole vaccinal valide avec un vaccin tétravalent.
Conclusions
L’épidémiologie de la leptospirose canine est complexe et, pour certains éléments fondamentaux comme les facteurs de risque d’infection et les populations réservoirs de leptospirose canine, les connaissances sont partielles. Le vétérinaire praticien doit inclure la suspicion de leptospirose lors de signes cliniques compatibles, mêmes frustes, en particulier chez les jeunes chiens et les chiens exposés aux milieux ruraux ou périurbains, en toute période de l’année et toute zone géographique de France métropolitaine. Les infections associées au sérogroupe Australis restent prédominantes parmi les cas cliniques. Dans une moindre mesure, le sérogroupe Sejroe pour lequel les vaccins disponibles n’apportent pas de protection spécifique est rapporté ces dernières années et devrait faire l’objet d’une vigilance particulière à l’avenir.
Remerciements
Laboratoire des Leptospires et d’Analyses Vétérinaires de VetAgro Sup et Pr Angeli Kodjo.
Références :
1. Ayral F, Djelouadji Z, Raton V, Zilber AL, Gasqui P, Faure E, Baurier F, Vourc'h G, Kodjo A, Combes B. Hedgehogs and Mustelid Species: Major Carriers of Pathogenic Leptospira, a Survey in 28 Animal Species
in France (20122015). PLoS One. 2016 Sep 28;11(9). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5040419/
2. Gros J. (2022) Etude du portage sain de leptospires dans un effectif de 56 chiens de chasse vivant en meute et vaccinés avec un vaccin tétravalent. Thèse de doctorat en médecine vétérinaire, VetAgro Sup.
3. Balboni A, Mazzotta E, Boniotti MB, Bertasio C, Bellinati L, Lucchese L, et al. Outbreak of Leptospira borgpetersenii Serogroup Sejroe Infection in Kennel: The Role of Dogs as Sentinel in Specific Environments. Int J Environ Res Public Health. 2022 Jan;19(7):3906.
4. Schuller S, Francey T, Hartmann K, Hugonnard M, Kohn B, Nally JE, et al. European consensus statement on leptospirosis in dogs and cats. J Small Anim Pract. 2015;56(3):159–79.
5. Barmettler R, Schweighauser A, Bigler S, Grooters AM, Francey T. Assessment of exposure to Leptospira serovars in veterinary staff and dog owners in contact with infected dogs. J Am Vet Med Assoc. 2011 Jan 15;238(2):183–8.
6. Ayral F. (2015) Vers une surveillance des zoonoses associées aux rats (Rattus norvegicus). Médecine vétérinaire et santé animale. Université Grenoble Alpes.
7. Taylor C, O’Neill DG, Catchpole B, Brodbelt DC. Incidence and demographic risk factors for leptospirosis in dogs in the UK. Vet Rec. 2022;190(6):e512.
8. Bertasio C, Boniotti MB, Lucchese L, Ceglie L, Bellinati L, Mazzucato M, et al. Detection of New Leptospira Genotypes Infecting Symptomatic Dogs: Is a New Vaccine Formulation Needed? Pathogens. 2020 Jun 18;9(6):484.
9. Hidalgo Friaz M., Barthelemy A., Savoie P., Freyburger L., Hugonnard M. Vaccination contre la leptospirose canine en France : enquête sur les pratiques vétérinaires et leurs motivations. Rev Vet Clin. 2023; 58(1) : 1-11. https://www.sciencedirect.com/science/article/pii/S2214567222001041



.png)